Uma das muitas pequenas satisfações que eu tenho com a cerveja (além de beber claro) é quando eu posso usar ela para falar de assuntos científicos/de engenharia avançados que quando estudados em sala de aula parecem isolados da realidade.
Nunca imaginei na que um dia ia falar com alguém que não fosse meus alunos na universidade da equação de Stokes (que diz a velocidade de decantação), da equação de Bernoulli e o Número de Reynolds (que podemos utilizar para dimensionar para dimensionar uma linha de serviço de cerveja para ela não espumar), da Lei de Fick (que nos faz entender como o aroma do lúpulo ou mesmo o CO2 é dissolvido na cerveja) e se eu pensasse mais um pouco possivelmente chegaria a uma dezena de exemplos.
Hoje vamos falar de mais duas equações que podem nos ajudar a ter uma precisão maior na carbonatação de nossa bem como entender melhor o efeito de diversos parâmetros que em um primeiro momento nem são associados à carbonatação. São elas a Lei de Henry e as equações termodinâmicas de estado, no nosso caso mais precisamente a Equação dos GasesIdeias.
Antes te continuar, pode ser bom que você assista o vídeo Entendendo a Carbonatação do Beer School no YouTube. É uma introdução bem didática de alguns pontos que vamos falar aqui.
Quando falamos em carbonatação, inevitavelmente temos que falar de equilíbrio. Parte do CO2 fica na fase gasosa, no headspace do fermentador, do barril ou da garrafa e parte do CO2 fica na cerveja em si. Se tiver muito CO2 no headspace, ele vai migrar para a cerveja até atingir o equilíbrio, isso é a carbonatação em si. Podemos deixar o headspace cheio de CO2 ligando a ele um cilindro pressurizado. Se tiver muito CO2 na cerveja, ele vai migrar pra fora até atingir o equilíbrio, isso seria a descarbonatação. Isso acontece quando deixado uma cerveja destampada e ela vai lentamente perdendo o gás.
Esse equilíbrio pode ser calculado pela Lei de Henry. Essa lei nos diz algo que pode parecem bem óbvio: Quanto mais gás no headspace, mais gás na cerveja, porem não necessariamente na mesma concentrçaão.
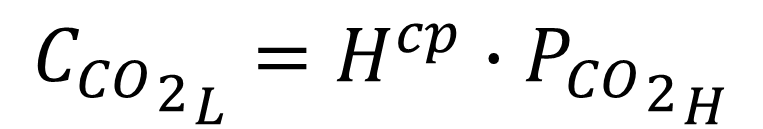
Em uma das muitas formas que essa lei pode ser expressa, temos a equação (1). Ela diz que o CO2 dissolvido no líquido é igual a pressão do headspace multiplicado por uma constante que nos dá a relação de equilíbrio.
À 13°C essa constante vale exatamente 2(g/L)/bar. Ou seja, para cada 1 bar de pressão no headspace (1bar ~ 1kg/cm2), a cerveja tem 2g/L de CO2. Falando assim parece até fácil né?
O problema é que na vida real as constantes variam mais que as variáveis e essa constante não é tão constante assim. Ela depende por exemplo da temperatura. Quando mais alta a temperatura, menos CO2 o líquido consegue absorver. E dessa relação, sai a nossa tão conhecida tabela de carbontação forçada.
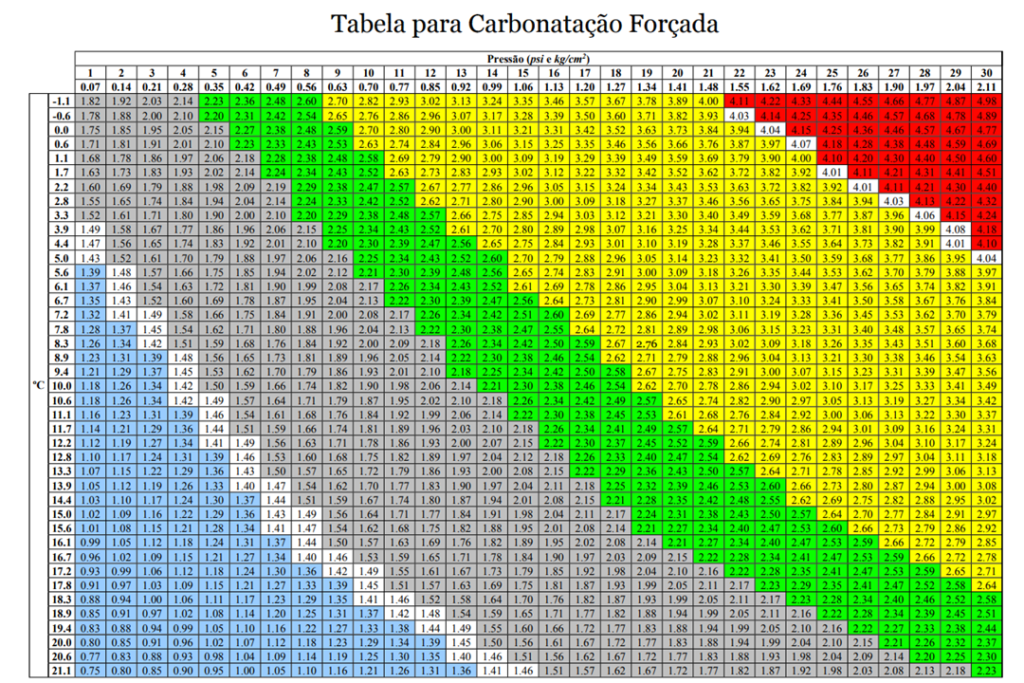
Essa tabela basicamente nos dá a relação de equilíbrio em cada temperatura e pressão. A única diferença é que ela expressa a concentração em volume de CO2 (unidade meio besta, mas é a padrão. Logo teremos um post só pra falar dela).
Não sei exatamente quem fez essa tabela ai, mas ela roda a internet cervejeira e é base para 99.9% dos cervejeiros, eu incluso, para carbonatar a cerveja. (Obrigado autor anônimo).
O fato é que ela veio de alguma adaptação da Lei de Henri. O artigo Carbon Dioxide Solubility in Beer publicado no Journal of the American Society of Brewing Chemists faz um compilado das principais equações de equilíbrio que pesquisadores cervejeiros determinaram ao longo da história.
Algumas são simples como a equação proposta por Holle:
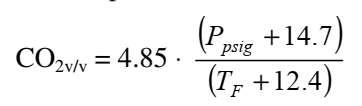
Note que a forma da equação é basicamente forma da Lei de Henri, divido pela temperatura. Com essa equação é possível construir a Tabela 1, basta jogar um monte de valores de pressão (em psi (lbf/in2)) e temperatura (°F).
Porém pesquisadores mais recentes notaram que outros parâmetros também influenciam no equilíbrio, como a FG da cerveja, o teor alcoólico e até a concentração de sais!
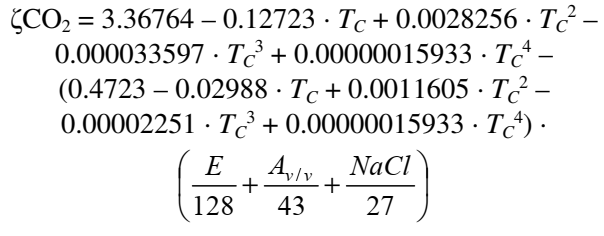
Essa equação nos dá a concentração de CO2 em g/(L·bar), sendo essa uma unidade muito melhor. Tc é a temperatura em °C, Av/v é o teor alcoólico da cerveja, NaCL é a concentração de sal em g/L e E é o extrato real (um forma mais precisa de expressar a FG).
A diferença entre usar a primeira equação, mais simples, e a segunda, que leva mais parâmetros em conta, pode ser de até 15%!
Em cervejas médias a primeira equação desempenha um papel muito bom. Por outro lado em cervejas muito alcoólicas ou pouco alcoólicas, ou cervejas muito atenuadas (como Bruts) ou pouco atenuadas (como as feitas com as “novas” leveduras Saccharomyces Cerevisiae var. chevalieri que atenuam em média 15%) o desvio do CO2 real para o calculado pode ser enorme e ter grande impacto sensorial.
Saindo um pouco do líquido, podemos utilizar a Equação dos Gases Ideias com impressionantes 99% (ou mais) de precisão para calcular a quantidade de gás no headspace. Confesso que fiquei surpreso e achava que teria que recorrer à equações mais complexas, mas aparentemente as condições usuais de T e P da cerveja são amenas suficientes para cair na faixa de validade dessa equação para o CO2.

Resumindo um pouco, com ela conseguimos calcular a concentração de gás na fase gasosa (headspace), isolando n/V (mol/L) e multiplicando pela massa molar do CO2 (g/mol).
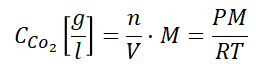
Para não me estender muito mais (acho que já deu de cálculos por hoje né?) deixo aqui um link para uma planilha no google sheets onde eu coloquei essas equações e algumas coisas a mais que pode ser utilizado para fazer diversas simulações. Para acessar a planilha clique aqui. Não esqueça de clicar em fazer uma cópia para poder editar!